京都大学(京大)は12月7日、分節時計が正しい時間を刻むには正しい数のイントロンが必要であることを発見したと発表した。同成果は同大 影山龍一郎 ウイルス研究所教授、播磨有希子 生命科学研究科大学院生らの研究グループによるもので、詳細は「Cell Reports」オンライン版に掲載された。
脊椎動物の体は、椎骨、肋骨、体幹の筋肉のような前後軸にしたがった繰り返し構造が基本になっており、これらは、発生過程に一過性に現れる繰り返し構造である体節から分化することが知られている。
体節が形成される時期の胎児の最尾部には、未分化な未分節中胚葉(PSM:presomitic mesoderm)と呼ばれる組織が存在し、細胞増殖によって後方に伸びていくと同時に、前方が一定時間(マウスでは約2時間)ごとにくびれ切られ(分節)、一定の大きさの繰り返し構造である体節が形成されるが、近年の研究により、このような周期性には、いくつかの分子の発現振動(オシレーション)が関わっており、周期的な体節形成過程を制御する分節時計として機能していることが明らかにされてきた。
研究グループでも、bHLH型転写因子Hes7が、2時間周期を刻む分節時計の本体であることを明らかにしてきたが、Hes7自身が分節時計のリズムを生み出す中心的なオシレーターなのか、もしくは他のオシレーターによって制御されているかということは分かっていなかったほか、正常な体節形成には、適切な周期による分節化が必要ながら、リズムの周期を制御するメカニズムも明らかになっていなかった。
Hes7遺伝子から発現したHes7タンパク質は、自身のプロモーター活性を抑制し、新たなHes7タンパク質の発現を阻害するが(ネガティブフィードバック)、Hes7タンパク質はユビキチン-プロテアソーム系ですぐに分解されるため、ネガティブフィードバックが解除されて再びHes7の発現が始まる。このように、Hes7は周期的な発現を繰り返すが、数理モデルのシミュレーションから、オシレーター遺伝子の転写からネガティブフィードバックに至るまでの時間の遅れ、すなわち転写、スプライシング、翻訳、さらにmRNAやタンパクの輸送などによって起こる適度な遅れが安定な発現振動および周期の長さに重要であると予想されたことから、今回、研究グループは、もしHes7が分節時計の中心的なオシレーターであるならば、Hes7遺伝子の転写にかかる時間の遅れを短縮させることにより、分節時計のリズムを速めることができるのではないかという仮説を立て、その検証のための実験を行った。
|
|
|
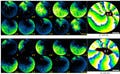
未分節中胚葉(PSM)における分節時計遺伝子の発現パターン。脊椎動物における体節形成過程では、体節はPSMから周期的に分節化されることにより形成される。マウス胎児では、この分節化は2時間周期で起こる。下のグラフは、上の模式図の点線上での、Hes7遺伝子の発現パターンを示している |
具体的には、Hes7遺伝子にある3個のイントロンから2個削減したトランスジェニックマウスの作製を行ったという。この結果、分節時計のリズムが速くなり、頚部から上位胸部の体節数が増加し、さらにこの領域の椎骨数も増加したことが確認され、これによりHes7遺伝子におけるイントロンの正常な数が分節時計の正常な周期に重要であることが示され、Hes7遺伝子は分節時計の周期形成に中心的な役割を担うことが明らかになったという。