慶應義塾大学(慶応大)医学部の仲嶋一範教授らの研究グループは10月18日、大脳皮質が形成される時に、神経細胞が正確に配置されるメカニズムを明らかにしたと発表した。同成果の詳細は10月18日(米国東部時間)発行の米国神経科学雑誌「Neuron」に掲載された。
哺乳類の大脳皮質は、多くの神経細胞が整然と並んだ6 層構造を作っているが、同構造は、哺乳類が進化の過程で獲得した特別な形質と考えられている。この層構造の形成過程において、神経細胞は脳の深部にある脳室の周囲で誕生し、放射状に脳表面に向かって移動して、表層付近で正しく移動を終了する。この際、遅れて生まれた神経細胞は早く生まれた先輩神経細胞をすべて乗り越え、より表層側に到達して停止することから、最終的には先輩細胞が深層に、後輩細胞が表層に並ぶ「inside-out」型と呼ばれる様式で層構造が形成されるが、この層構造形成で異常が、発達障害や統合失調症、てんかんといった精神神経疾患の患者で多数報告されていることから、神経細胞を正しく配置させるメカニズムの重要性が示唆されるようになってきた。
近年の研究により、神経細胞は複雑に移動様式を変化させながら動いていくことがわかってきた。例えば大脳皮質神経細胞の7~8割を占める興奮性神経細胞の場合、すでに移動を終えた先輩細胞の集団の中を、脳を貫くように走る長い線維(放射状グリア)につかまりながら、後輩の神経細胞がよじ登っていく様子が報告されている。しかし、放射状グリアの線維は脳の表層まで伸びているにもかかわらず、神経細胞がその途中でどのようにして移動を終了するのかは不明であった。
研究グループは、神経細胞の移動終了地点で発現し、大脳皮質の層構造形成に決定的な役割を持つ細胞外タンパク質「リーリン」に着目して研究を進めてきた。リーリンの異常は滑脳症と呼ばれる脳構造異常の原因の1つであり、統合失調症や自閉症などの精神神経疾患との関連も示唆されているほか、リーリン欠損マウスにおいては、大脳皮質の層構造がおおまかに逆転してしまうことから、リーリンの層構造形成における重要性が示唆されてきた。
リーリンは、移動神経細胞に発現し、リーリンの受け取り手であるApoER2/VLDLRと呼ばれるリーリン受容体に結合した後、細胞内タンパク質であるDab1 をリン酸化することが知られている。しかし、実際の大脳皮質内において、いかにしてリーリンが神経細胞の"inside-out"型の配置を制御しているのかは、リーリン欠損マウスの発見から半世紀以上が経過した現在でも、依然として謎のままであった。
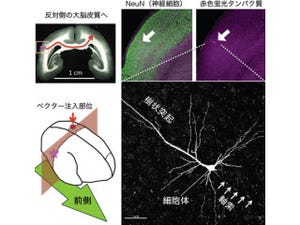
研究グループは2011年、発生期の大脳皮質において脳表面付近で一過性に観察される特徴的な領域を同定。それを「原皮質帯(primitive cortical zone:PCZ)」と命名し、リーリンがこの原皮質帯への進入に関わる特殊な移動様式を制御していること、ならびに原皮質帯が"inside-out"型の最終配置が決定される場所であることを報告しており、今回の研究は、このリーリンと原皮質帯の関係に着目し、リーリンによる"inside-out"型の細胞配置のメカニズムを明らかにすることを目的に進められた。 具体的胃は、研究グループが開発した簡便な遺伝子導入法である「子宮内電気穿孔法」と、遺伝子の機能を簡単に阻害することができる「RNA干渉法」を組み合わせることで、原皮質帯への進入の分子機構の解析を行った。
最初に、Dab1のリン酸化が原皮質帯への進入に必要であるかを検証した。Dab1はリーリンによって複数のチロシン残基がリン酸化されることが知られている。Dab1をRNA干渉法でノックダウンすると、原皮質帯への進入が阻害されるものの、この表現型は野生型のDab1を同時に導入することで元に戻るで、リーリン刺激によってリン酸化されるすべてのチロシン残基を変異させリン酸化できなくしたDab1では元に戻らないことが観察された。
さらに解析を進めたところ、Dab1の220番目ないし232番目のチロシンのリン酸化が必要であることが見いだされたという。この実験により、Dab1の下流分子(作用を細胞内に伝達する分子)の候補として、Crk/CrkLと呼ばれるタンパク質が挙がったため、RNA干渉法を用いて解析したところ、Crk/CrkLが確かに原皮質帯への進入を含む細胞移動を制御していることが判明したほか、Crk/CrkLと結合しリーリンで活性化されるC3Gと呼ばれるタンパク質も、原皮質帯への進入に必要であることが見出された。
C3Gは、Rap1と呼ばれる低分子量Gタンパク質の活性化因子であることが知られており、Rap1の機能を解析するためにSpa1というRap1の阻害因子を子宮内電気穿孔法で移動神経細胞に導入し結果、Rap1を阻害した場合には原皮質帯への進入に異常が出ることが確認された。この結果から、リーリンによるC3Gを介したRap1の活性化が、原皮質帯への進入を制御していることが判明した。
加えて研究グループでは、原皮質帯への進入が放射状グリアに依存しない特殊な移動様式(ターミナルトランスロケーション:terminal translocation)で起こることから、神経細胞が周囲の細胞外環境を足場にして動き、移動を終了するのではないかという仮説を立てた。
原皮質帯を含む脳表面で特異的に発現する分子があることは以前より研究グループが報告してきていたが、今回はその中で、フィブロネクチンと呼ばれる、細胞の移動に重要な足場となる細胞外マトリックスが多く発現していることに着目したという。フィブロネクチンは、移動細胞のインテグリンα5β1と呼ばれる接着分子と結合することが知られている。移動神経細胞は、先導突起と呼ばれる突起を伸ばし、その後に核を含む細胞体を持ち上げ、さらにまた先導突起が伸び、という過程を繰り返して移動するが、研究グループは、原皮質帯付近のフィブロネクチン発現部位において、インテグリンβ1が移動神経細胞の先導突起で活性化されていることを見出した。
しかしリーリン欠損マウスにおいてはこのインテグリンβ1の活性化が観察されないことから、リーリンによるインテグリンα5β1の活性化が原皮質帯への進入に重要なのではないかと考え、解析を進めた結果、実際にリーリンがインテグリンα5β1を活性化することを見出し、リーリンによって神経細胞とフィブロネクチンとの接着が亢進することも明らかとした。
さらにインテグリンα5β1の作用をRNA干渉法で阻害すると、原皮質帯への進入に異常が見られたことから、インテグリンα5β1が原皮質帯への進入に必要であることが判明したほか、リーリン受容体をRNA干渉法で阻害して原皮質帯への進入が阻害された表現型が、インテグリンα5β1の恒常的活性化型(および別の下流分子であるAkt)を導入することで正常化することから、インテグリンα5β1の活性化がリーリンの下流で起こり原皮質帯への進入を制御していることを突き止めた。
|
|
|
リーリンは、(1)神経細胞に発現するApoER2/VLDLRと呼ばれるリーリン受容体に結合し、(2)Dab1のリン酸化によるCrk/CrkL-C3Gの活性化を介してRap1を活性化する。(3)活性化されたRap1は、結合する下流の分子を連れてきて活性化することで、(4)インテグリンα5β1の構造変化による活性化を引き起こし、(5)細胞外マトリックスであるフィブロネクチンへの接着が亢進する |
最終的に、インテグリンα5β1の阻害がリーリンの阻害と同様に細胞の最終的な配置である"inside-out"型に影響を与えるかを、子宮内電気穿孔法を連続して2回実施し、先輩細胞と後輩細胞を別々に標識して解析し、確かに最終配置に乱れが生じることを確認したという。これら実験から、放射状グリアを伝って大脳皮質内をよじ登ってきた神経細胞は、原皮質帯の直下に到達してその先導突起先端でリーリンを受け取ると、細胞内の経路を介して先導突起のインテグリンα5β1を細胞の中から活性化させることが判明。その結果、あたかもロッククライマーが切り立った崖の頂上で自らの手をかけて体を持ち上げるように、力強く細胞体を持ち上げる(ターミナルトランスロケーション:terminal translocation)ことで原皮質帯への進入が起こり、最終配置部位、すなわち原皮質帯の最表層部分に正しく定着することが明らかとなった。これにより、脳の深部で生まれて次々に脳表面に向かって移動してくる神経細胞は、原皮質帯のところでこの仕組みにより先輩細胞を乗り越えて次々に最表層に到達し、"inside-out"型の層構造形成が実現されるということが判明したこととなった。
今回の研究では、リーリンという細胞外のシグナルが細胞内の情報伝達経路を介してインテグリンα5β1を細胞内から活性化する経路を明らかにしたが、実はインテグリンα5β1そのものも細胞外からの情報を受け取って細胞内へとシグナルを伝えており、このシグナル伝達経路がどのようにして原皮質帯内での細胞の運動を制御しているのかは、まだ未解明であり、今後の研究の発展が必要になるという。
一方、リーリンは神経細胞の情報入力部位である樹状突起の形態も制御しているが、インテグリンα5β1は樹状突起形成には大きくは影響を与えていない可能性が示唆されたことかた、リーリンはインテグリンα5β1非依存的に樹状突起形成を制御している可能性があり、リーリンの大脳皮質形成における多様な分子経路の存在が示唆されることとなったことから、研究グループでは、リーリンを鍵としたさまざまな分子経路を明らかにすることで、将来の発達障害やてんかんなどの病態解明や新しい治療法の開発へとつなげていきたいと考えているとしている。
また、近年、試験管内での神経組織の再生研究が進み、移植による脊髄損傷等の治療も研究されているが、将来的には、脳血管障害や神経変性疾患などで障害を受けた大脳皮質も、再生医療の対象になりうるものと期待されるとするほか、リーリンは大脳皮質を含めて脳内の多くの部位で神経細胞の正しい配置を制御しているため、今回の研究成果が、将来の脳の再生医療において神経細胞を正しく配置させる手法を確立するための基盤になることが期待されるともコメントしている。