京都大学iPS細胞研究所(CiRA:サイラ)と科学技術振興機構(JST)は8月2日、ALS(筋萎縮性側索硬化症)患者から樹立したiPS細胞を用いて、ALSのこれまで知られていなかった病態を解明し、ALSに対する新規治療薬シーズが発見されたと発表した。
成果は、江川斉宏研究員(CiRA/JST CREST)、北岡志保研究員(元CiRA/JST CREST)、井上治久准教授(CiRA/JST CREST/JST 山中iPS細胞特別プロジェクト)、山中伸弥教授(CiRA/京大 物質-細胞統合システム拠点/JST 山中iPS細胞特別プロジェクト)や高橋良輔教授(京大 大学院医学研究科)らの研究グループによるもの。研究の詳細な内容は、米国東部時間8月1日付けで米国科学誌「Science Translational Medicine」オンライン版に掲載された。
ALSは50~60歳ごろから発症し、運動ニューロンが変性することで次第に全身が動かなくなる病気だ。ALSの病理組織を観察すると、運動ニューロンの細胞質に凝集体が観察される。この凝集体は、RNA結合タンパク質「TDP-43」が集まったものであることが明らかにされていた。
また、これまでALS病態を示す動物モデルが報告され、その中でもALSモデルマウスを用いた研究では病状を改善する治療薬候補がいくつか同定されている。しかし、その治療薬候補の中で、ALS患者に投与され治療の有効性が示されたものは未だない。
そのため、動物モデルよりさらに患者に近いヒトの細胞系でのモデル構築が求められていた。これまでにALS患者からiPS細胞を樹立し、運動ニューロンへと分化誘導することは行われてきたが、ALSの病態に関して不明な点が多く、どのように培養皿の中でALSの病態を再現して、治療薬候補の探索を行うべきかがわかっていなかったのである。
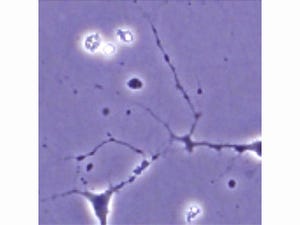
ALSに罹患していないコントロール(健常者)5名から樹立したiPS細胞と、TDP-43に変異のあるALS患者3名から樹立したiPS細胞を用いて、それぞれ運動ニューロンへと分化誘導させたところ、ALS患者由来の細胞では、コントロール由来の細胞と比較して、神経細胞骨格を作る遺伝子のmRNA(メッセンジャーRNA)量が低下し、神経突起が短くなっていることが明らかとなった(画像1・2)。
さらに、TDP-43のmRNA量が増加し、ALS患者で見られるのと同じようなTDP-43タンパク質の凝集体形成が生じていること、ストレスに対して脆弱になっていることが見出されたのである。このように、ALS患者由来のiPS細胞を用いて、ALS病態モデルを構築することに成功した。
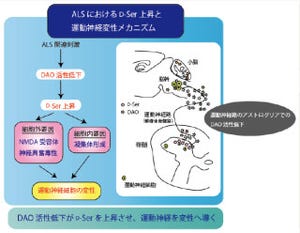
遺伝子発現の解析から、ALS患者由来のiPS細胞から作製した運動ニューロンでは、RNAの合成や運搬(RNA代謝)に異常があると推測(画像3)。そこで、RNA代謝に作用することが知られている4つの化合物をそれぞれ作用させたところ、「アナカルジン酸」には、TDP-43の発現量を低下させ、ALS運動ニューロンのストレスに対する脆弱性と神経突起の長さを改善する効果があることがわかった(画像4)。
多くの「孤発性」(「家族性」と異なり、遺伝子以外に要因があることが推測されている)のALS患者の病理組織の運動ニューロンにTDP-43タンパク質の凝集体が見られることから、TDP-43の異常を制御するという今回の研究の治療薬シーズは、患者の大半を占める孤発性のALSにも効果があることが期待されるという。
今後は、患者のiPS細胞を用いて、病態のさらなる解明を進めると共に、治療薬シーズ探索基盤を進化させて、多くの治療薬候補を得る必要があると、研究グループは述べている。