慶應義塾大学(慶応大)と科学技術振興機構(JST)は6月7日、東京大学、順天堂大学との共同研究により、「がん幹細胞表面マーカー」である接着分子「CD44」が、がん細胞の酸化ストレス抵抗性を高めることによって、乳がん細胞の肺転移を促進する分子機構について解明したと発表した。
成果は、慶應大 先端医科学研究所 遺伝子制御研究部門の永野修専任講師、八戸敏史研究員、慶應大 医学部 医化学教室、東京大学 先端科学技術研究センターの油谷浩幸教授、同南敬教授、順天堂大学呼吸器内科教室の高橋和久教授らの共同研究グループによるもの。研究の詳細な内容は、英国時間6月6日付けで英科学専門誌「Nature Communications」オンライン版に掲載された。
がん幹細胞は腫瘍組織形成の大本になる細胞であり、治療に対する抵抗性が高いことから、がんの再発、転移などの起源になると考えられている。血液性のがんを除いた、乳がん、膵臓がん、胃がん、大腸がんといった固形がんにおいては、CD44陽性のがん細胞は免疫不全マウスでの腫瘍形成能力が高く、CD44陽性のがん細胞はがん幹細胞様の性質を持つことが報告されてきた。
また、これまでの報告から、さまざまな固形がんにおけるCD44のバリアントアイソフォーム(若干異なる構造を持つタンパク質)である「CD44v」の発現は、遠隔転移と相関していることが知られている。
慶應大医学部の研究チームは、CD44vが「シスチントランスポーターxCT」の発現を上昇させ、抗酸化物質である「還元型グルタチオン(GSH)」の合成を促進することで、がん細胞における酸化ストレス抵抗性を高め、腫瘍の増大や治療抵抗性に寄与することを以前に報告済みだ。
そこで今回、永野専任講師らは、CD44vが転移の過程でがん細胞が受ける酸化ストレスを抑えることにより転移を促進するのではないかと考え、その分子メカニズムの解明に向けて今回の研究に取り組んだのである。
まず、高転移性のマウス乳がん細胞株「4T1細胞」と、4T1細胞と同一の遺伝子背景を有する低転移性あるいは非転移性の乳がん細胞株(「4TO7細胞」、「168FARN細胞」、「67NR細胞」)を用いて、CD44vの発現の確認がなされた。その結果、高転移性である4T1細胞のみCD44vのメッセンジャーRNA(mRNA)が多く作られていることが判明。
そこで、細胞膜表面におけるCD44vの発現について、細胞の和哉特長を計測できる「フローサイトメトリー」を用いて検出したところ、4T1細胞のみが、CD44vを高く発現していることがわかった。さらに4T1細胞は、CD44v陽性細胞と、CD44v陰性でCD44スタンダードフォーム(CD44s)陽性細胞の2種類の細胞画分に分離できることが見出されたのである。
さらに、CD44v陽性細胞及びCD44v陰性(CD44s陽性)細胞をそれぞれマウス乳腺へ同所移植した後に、肺への転移の有無や転移巣の大きさについて検討したところ、両群とも原発巣の大きさについては、ほとんど変わらないものの、肺転移能はCD44v陰性細胞に比べて、CD44v陽性細胞で明らかに高いことが確認された。
これまでの研究でCD44vは、がん細胞の細胞膜表面においてxCTを安定化させることで細胞外からのシスチンの取り込み量を増加させ、細胞内の主要な抗酸化物質であるGSHの生成を促進することを見出している。
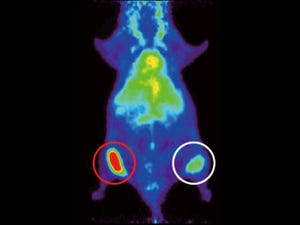
そこで、肺転移巣におけるCD44v陽性細胞のGSH量を質量分析イメージング法により検討したところ、CD44vを高発現する肺転移巣では明らかにGSHが多く含まれていることがわかった(画像1)。
画像1は、マウス肺転移巣におけるCD44v発現とGSHの質量分析イメージング像。CD44vを高発現するマウス肺転移巣では、「酸化型グルタチオン(GSSG)」と比較して明らかに、GSHが高く検出される。H&Eとは、ヘマトキシリン・エオジン染色像のこと。
さらに、CD44mRNAの「選択的スプライシング」の制御因子「ESRP1タンパク質」の発現を、「RNA干渉法(RNAi)」を用いて抑制すると、xCTの細胞表面における発現及び細胞内GSH含有量は著明に低下し、その結果、CD44v陽性4T1細胞の肺転移を著明に抑制できることがわかった(画像2)。
また、xCTに対し特異的に阻害作用を示すことが知られている既存薬の「スルファサラジン」によっても同様に肺転移を抑制できることなどから、ESRP1タンパク質によって促進されるCD44vの発現は、xCTの細胞膜における発現を上昇させることで抗酸化物質GSHの合成を促進し、乳がん細胞が転移の過程で受ける酸化ストレスに対して抵抗性を高め、転移を促進することがわかった。
画像2は、マウス肺転移巣のイメージング画像で、#1~4とあるのは、それぞれ異なるマウスのもの。ESRP1の発現をノックダウン(抑制)することにより、高転移性であるCD44v陽性細胞による肺転移を著明に抑えることに成功した。ESRP1の発現をノックダウンした4T1細胞を同所移植したマウス肺では、蛍光シグナルが抑えられており、肺転移が抑制されていることがわかる。
次に転移性乳がん細胞におけるESRP1の発現制御機構についての調査が行われた。これまでの研究から、「上皮-間葉転換(EMT)」がESRP1の発現低下を誘導することは知られている。そこで、EMTマーカーの発現についてCD44v陽性4T1細胞とCD44v陰性細胞について検討したところ、ほとんど両者には差が無かったことから、EMT以外の機構でESRP1の発現が制御されていると考察された。
近年、「エピジェネティック」な制御(クロマチンへの修飾による遺伝子発現の後天的な制御のこと)機構、特に「ヒストン修飾」が選択的スプライシングの制御に重要であることが発表されている。そこでESRP1のエピジェネティックな制御機構について検討したところ、CD44v陽性4T1細胞とCD44v陰性細胞のESRP1の発現にはESRP1遺伝子座のヒストン修飾の変化が関連していることがわかった。
これらのことから、転移性乳がん細胞におけるESRP1及びCD44vの発現制御には、EMTよりも、むしろヒストン修飾によるエピジェネティックな発現制御機構が重要であると考えられたのである。
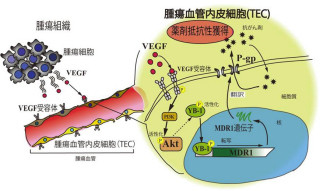
これらの結果から、CD44を介した酸化ストレス抑制機構は、腫瘍の増大や治療に対する抵抗性のみならず、がんの転移にも寄与していることが判明した(画像3)。
今回の研究によって、CD44vの発現が高いがんにおいてはCD44vやxCTを標的とした治療を行うことで、がん幹細胞及び転移性乳がん細胞を標的とした治療法を開発できる可能性が示された形である。
また、ESRP1のエピジェネティック制御という新たなCD44v発現制御機構の解明は、転移性乳がん細胞に対する治療の新規標的分子の発見に繋がることが予想され、がん転移治療薬開発において大変重要な意義を持つと考えられるという。
画像3は、CD44v陽性乳がん細胞の肺転移メカニズムの模式図。ESRP1の発現によってCD44vが陽性となったがん細胞は酸化ストレスを抑制する能力が高く、治療に対して抵抗性を示す細胞である。これらの細胞は転移の際に生じる酸化ストレスに対しても抵抗性を発揮し、転移巣の成立と拡大に関与する。
今後の展開としては、xCTに対し、特異的に阻害作用を示すことが知られているスルファサラジンを用いた動物実験により、有意な腫瘍抑制効果、抗がん剤感受性増強効果が得られていることから、現在、慶應義塾大学 医学部の研究グループは、スルファサラジンを用いた医師主導型第一相臨床治験を国立がん研究センター 東病院らと共同で実施すべく、計画を進めている。
今回の発表は、がん幹細胞の主要な表面マーカーの1つであるCD44を介した酸化ストレス抑制機構が、乳がんの肺への転移を促進することを明らかにしたものだ。これらの知見は、CD44を高発現する転移性乳がん細胞を標的にした治療法の確立に繋がる大きな可能性を秘めていると研究グループはコメントしている。