大阪大学(阪大)蛋白質研究所は、東京大学と早稲田大学と共同で、細胞内でさまざまな物質の輸送を駆動するタンパク質分子モーター「ダイニン」の原子構造を決定し、この巨大な分子モーターが長い脚のような構造を使って細胞の中を歩く仕組みの一端を明らかにしたと発表した。
成果は、阪大蛋白質研究所の栗栖源嗣(くりすげんじ)教授と昆隆英(こんたかひで)准教授、東京大学と早稲田大学の研究者による研究グループによるもの。詳細な研究内容は、英科学誌「Nature」への掲載に先立ち、日本時間3月8日付けでオンライン版に掲載された。
ヒトの体を構成する細胞内では、分子モーターと呼ばれるタンパク質群が化学エネルギーを力学的運動へと変換することで、生命活動に必要なさまざまな細胞運動を駆動している。
それらの中で、細胞内物質輸送や繊毛・鞭毛運動を担うダイニンは、分子としての複雑さと分子サイズの巨大さゆえに、主要な分子モーターの中で唯一、全体の立体構造が明らかではなく、その運動機構が謎に包まれていた。
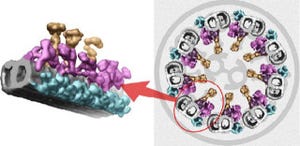
画像は、今回、研究グループが明らかにした細胞性粘菌が持つダイニンモーターの原子分解能での立体構造だ。
ダイニンは、地球上の生物が共通して用いているエネルギー源の「ATP(アデノシン三リン酸)」を加水分解するリングから長い脚(黄色と橙色)が突き出した構造を持つことが明らかになり、ダイニンがこの脚を構造変化させながら微小管と呼ばれるレールの上を移動することを強く示唆する結果が得られた形である。
また、力発生を担うレバーアーム様の構造(青色)がリングをまたぐように位置することも可視化され、ダイニンがATP加水分解で得られた化学エネルギーを力学的運動に変換する仕組みについて、原子レベルの構造的知見が得られた次第だ。
これらの構造的特徴は、従来知られていた「ミオシン」や「キネシン」などの小型分子モーターとはまったく異なるものであり、ダイニンは、新しい運動の仕組みによってレール上を運動する分子モーターであることが明らかになった。
なお、このタンパク質構造は、理化学研究所が所有する大型放射光施設「SPring-8」に大阪大学が設置しているビームライン「BL44XU」を用いることで得られたもので、これまでに構造決定された最長ポリペプチド鎖のレコードを更新するものとなっている。
ダイニンモーターは、生物が生きていく上で欠くことのできないタンパク質分子だ。細胞内では、細胞中心方向への輸送のほぼすべてを担っており、さまざまな小胞、細胞内小器官、RNAそしてタンパク質複合体の移動・配置に必須な役割を果たす。また、紡錘体形成や染色体分離など細胞分裂のキープロセスにも深く関与している。さらに、精子の運動や卵子の輸送を駆動する唯一の分子モーターだ。
今回の研究結果は、これら生体に重要な細胞運動がどのような仕組みで駆動されているのか、その基本的なメカニズムを明らかにした、重要な研究成果であるといえる。
なお、ダイニンモーターの機能あるいは部分的な機能不全はさまざまなヒトの疾病と深く関連することが示唆されている。例えば、10種類以上のウィルスが感染過程でダイニン複合体をハイジャックすることが示されているという。また、ある種の神経変性疾患や不妊・排卵障害の一部はダイニンモーターの機能異常と関連があるとも考えられるとした。
今回の研究を基盤としてダイニン運動機構理解が進展すれば、これらダイニン関連病の発症機構が明らかになると期待されると研究グループはコメントしている。