理化学研究所(理研)と科学技術振興機構は2月8日、「気道過敏性」発症に中心的な役割をする「IL-17RB陽性NKT細胞」が、胸腺で独立に分化することを突き止め、小児ぜんそく発症のカギを握る細胞であることを明らかにしたと共同で発表した。研究は理研免疫・アレルギー科学総合研究センター免疫制御研究グループの谷口克グループディレクターと渡会浩志上級研究員(独立行政法人科学技術振興機構(JST)・さきがけ研究者兼任)らの研究グループによるもので、成果は米科学雑誌「PLoS Biology」オンライン版に日本時間2月8日に掲載された。
アレルギー疾患は日本人の約30%がかかっており、国民的な病気の1つとなっている。中でもアレルギー性ぜんそくの患者数は世界で3億人、日本で約300万人と報告され、死亡者数は世界で年間25万人超、日本でも3000人超にもおよび、年々増加の一途をたどっている状況だ(世界保健機関の疾病および関連保健問題の国際統計分類)。特に小児ぜんそくは、小学校入学前の約6%の子どもが発症し、その数は1980年代に比べて6倍に増加しており、治療法の確立が強く求められている次第である。
アレルギーは、外来性の物質(抗原)に対して免疫系が過剰に反応して起こる炎症性反応だ。多くのぜんそく患者では、気管支が収縮して呼吸困難となる発作である気道過敏性が見られる。
その発症の仕組みは、気道から侵入した抗原に対して免疫系細胞である「ヘルパーT(Th)細胞」がIL(インターロイキン)-4、IL-5、IL-13といった「サイトカイン」(細胞どうしの情報伝達に関わるさまざまな生理活性を持つタンパク質の総称)を産生し、気道の炎症を引き起こすというものだ。なおインターロイキンとは、白血球によって分泌され細胞間コミュニケーションの機能を果たす細胞伝達物質のこと。
そして、抗原刺激の度にこの反応が繰り返され、気道組織の損傷とそれを修復しようという反応がたび重なる結果、炎症が慢性化して組織の構造が変化し、さらに気道過敏性が悪化して少量の抗原にも発作が起こるようになってしまうのである。
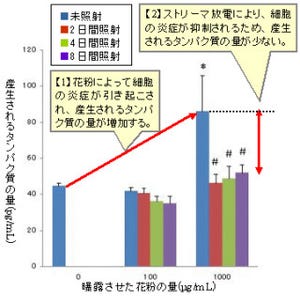
2008年に研究チームは、ヘルパーT細胞の分化の誘導・活性化や気道壁の肥厚に関与すると考えられ、このような病態形成に至る引き金を引く細胞の1つがNKT細胞の内でもIL-17RBを細胞表面に有する特定の細胞集団のIL-17RB陽性NKT細胞であることを突き止めた(画像1)。
なお、IL-17RB陽性NKT細胞は、細胞、B細胞、NK(ナチュラルキラー)細胞に続く第4のリンパ球決定系列で、免疫の制御や、がんの免疫学的監視などさまざまな役割を担うNKT細胞の内、受容体IL-17RBを発現する細胞である。
この結果から、この細胞集団の発生起源や機能の詳細を明らかにしてその作用を押さえることができれば、新たなぜんそく治療法の開発につながると、研究グループでは考察。しかし、IL-17RB陽性NKT細胞が体内でどのような経路をたどって分化するのか、詳細な機能については不明なままだったのである。
これまでNKT細胞の分化経路として、ヘルパーT細胞のマーカーであるCD4とキラーT細胞のマーカーであるCD8の両方が陽性のCD4+CD8+細胞を起源として、胸腺(細胞の分化や成熟など免疫系に関与し、胸小葉と呼ばれる二葉からなり、胸骨の後ろ、心臓の前に位置し、心臓に乗るように存在する臓器)内でステージ1(CD44陰性NK1.1 陰性)、ステージ2(CD44陽性NK1.1 陰性)、ステージ3(CD44陽性NK1.1 陽性)の順に分化し、末梢へと移動することが知られていた(画像2・A)。そこで研究グループは、IL-17RB陽性NKT細胞の発生起源を特定するため、胸腺に存在するNKT細胞を詳細に解析したのである。
|
|
|
画像2。(A)これまで報告されていたNKT細胞分化発生モデル。(B)IL-17RB陽性NKT細胞の発生モデル。(C)IL-17RB陰性NKT細胞の発生モデル。IL-17RB陰性NKT細胞は、CD4陽性/陰性ともに肝臓、骨髄、脾臓などに存在し、IFN-γ(インターフェロンガンマ)を産出する |
まず、IL-17RBを特異的に認識する「モノクローナル抗体」を用いて、生後4~6週(乳幼児相当)のマウス胸腺内のNKT細胞のIL-17RBの発現が調べられた。モノクローナル抗体とは、1つのクローン細胞群が作る1種類の抗体のこと。体内や細胞に微量に存在する物質の検定や精製・局在性を調べるのに有効で、病気の診断・治療にも利用されている。
その結果、胸線内のNKT細胞の10%程度に、IL-17RBが発現することが判明した。さらに、IL-17RB陽性NKT細胞の大半がステージ1とステージ2に存在することに加え、これまでNKT細胞の形成維持と数の増加に必須と考えられていたIL-15を必要としないことも見出された。
そして、このIL-17RB陽性NKT細胞は、ステージ1からステージ2へと分化発生したあとに末梢へと移動することを突き止め、これまで考えられてきたNKT細胞とは違う独自の分化経路で発生する細胞集団であることが明らかとなったのである(画像2・B)。
画像2・BはIL-17RB陽性NKT細胞の発生モデルで、IL-17RB陽性NKT細胞は初期の分化段階から別個に存在し、胸腺NKT前駆細胞を経てステージ1から2をたどり、末梢(肺、リンパ節、脾臓など)に移行するというもの(赤線囲み)。さらに、このIL-17RB陽性NKT細胞は、CD4陰性とCD4陽性に別れ、CD4陰性からはTh17サイトカインを、CD4陽性からはTh2、9、17サイトカインを産生し、炎症誘導反応の中心を担う。
また、胸腺内のIL-17RB陽性NKT細胞の数はマウスの系統によって異なり、アレルギーを発症しやすい系統のマウスでは、発症しにくい系統のマウスより3~4倍多く発現することもわかった。これは、アレルギーやぜんそくになりやすい体質であるかどうかは、IL-17RB陽性NKT細胞の存在数に関わることを示している。
これまでに研究チームは、IL-17RB陽性NKT細胞がTh2サイトカインを大量に産生することを確認済みだ。今回、IL-17RB陽性NKT細胞の機能を確かめるため、IL-17RBをコードする「Il17rb遺伝子」を欠損させたIl17rbノックアウトマウスが作製され、サイトカイン産生能力の調査も行われた。
その結果、Th2サイトカインだけでなく、Th9サイトカイン(IL-9、IL-10)やTh17サイトカイン(IL-17A、IL-22)の生産能力が低下したため、IL-17RB陽性NKT細胞はTh2サイトカインだけでなく、Th9サイトカインやTh17サイトカインも産生する能力を有していることが確かめられたのである。
前述したように、IL-17RB陽性NKT細胞は、CD4の有無によって陽性と陰性に分かれ、IL-17RB陽性CD4陰性NKT細胞はTh17サイトカインを、IL-17RB陽性CD4陽性NKT細胞はTh2、Th9、Th17サイトカインを産生することが判明。これらのサイトカインは、直接アレルギー反応を誘導するサイトカイン群として知られる一方、ほかの免疫細胞や「多形核白血球」に作用して炎症を誘導することが知られている。従って、IL-17RB陽性NKT細胞の活性化が引き金となり、免疫反応の経路のあらゆるところで炎症誘導が引き起こされることが示されているというわけだ。
IL-17RB陽性NKT細胞は、マウスでは肺などの限られた場所に集積し、幼少期に多く存在する。そして小児ぜんそく患者は、冬季に流行するRSウイルスに感染すると、重篤な細気管支炎や肺炎を引き起こしてしまう。そこで、RSウイルスに感染したモデルマウスを解析したところ、NKT細胞ノックアウトマウスやIl17rbノックアウトマウスでは、アレルギー気道炎症が誘導されなかった(画像3)。
しかし、NKT細胞ノックアウトマウスにIL-17RB陽性NKT細胞を移入すると、RSウイルスによって誘発されるアレルギー気道炎症が細胞数の増加とともに悪化することが判明。従って、IL-17RB陽性NKT細胞がRSウイルスによる炎症誘導の中心を担っていると考えられるという結論に至ったのである。
今回の研究により、IL-17RB陽性NKT細胞が胸腺で、独自の経路をたどって分化すること、そしてこの細胞がさまざまな炎症の誘導に関わるサイトカインの産生に関与していることがわかった。今回の研究ではマウスが用いられたが、今後は、乳児や小児におけるIL-17RB陽性NKT細胞の役割を詳細に解析することが重要となると、研究グループでは考えている。この細胞の機能を抗体治療などで人為的に抑制することで、気道過敏性の悪化を抑えることができ、社会的要請の高い小児ぜんそくの効果的な治療法の開発につながるものと期待できるとしている。