大阪大学(阪大)と科学技術振興機構(JST)は10月24日、ES細胞において遺伝子機能を迅速に解析する新手法を開発したと共同で発表した。研究は阪大大学院医学系研究科の堀江恭二准教授および竹田潤二教授らによるもので、成果は米国東部時間10月23日付けで「Nature Methods」オンライン速報版に掲載された。
ES細胞は、培養皿上でさまざまな種類の細胞へ分化させることが可能だ。そのため、培養皿上で多様な生命現象を解析することができる。ES細胞の万能性は、ヒト難治疾患の治療の観点からも期待されており、培養皿上で分化させた細胞をヒトへと委嘱するための研究が進行中だ。ただし、このようなES細胞の応用性を高めるためには、約2万個あるとされる遺伝子の機能に関して、包括的に解析するための技術が必要だ。
遺伝子機能を調べるための一般的方法として、「目的の遺伝子を破壊した細胞を作成し、その影響を調べる」手法が、これまでさまざまな生物種において多くの研究者によって用いられてきた。しかし、各遺伝子は細胞につき2コピーずつ存在するため、遺伝子機能を解析するためには、両方のコピーを破壊する必要があり、研究遂行上の律速段階となっている。
目的のゲノム領域と相同なDNA配列を単離後、改変を加えて細胞へ導入し、ゲノム配列と外来性相同配列との間で生じる組み換えを利用してゲノムを改変する「ジーンターゲティング」は、最も広く用いられている方法だが、この方法では遺伝子破壊のみならず、さまざまなゲノム改変が可能になる一方で、多大な時間と労力を必要とし、例えば両方のコピーを破壊したマウスを作成するには、半年から1年程度の時間がかかってしまう。そのため、1人の研究者が解析できる遺伝子数は、極少数に限られているのが現状の課題だ。
また、遺伝子機能を簡便に阻害するには、標的とするRNAに相補的な2本鎖RNAを細胞内に導入することで、標的RNAが分解される現象を利用した「RNA干渉」が広く用いられている。しかし、この方法では遺伝子発現を低下させることはできても、完全な破壊は不可能であり、目的以外の遺伝子が阻害されてしまう可能性もあるのが課題だ。
そうした課題を解決すべく、研究グループは今回、マウスのES細胞において両方のコピーを迅速に破壊し、遺伝子機能を網羅的に解析することが可能な手法を構築したのである。
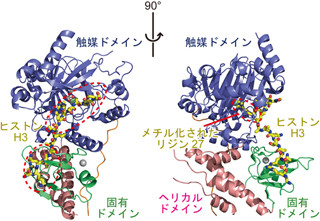
マウスES細胞のゲノムのさまざまな部位へ、後述する薬剤耐性遺伝子を含むDNA断片を挿入し、ES細胞の遺伝子をまずは1コピーのみ、ランダムに破壊(画像1)。次に、研究グループが以前に報告した「Bloom遺伝子」の発現抑制により、染色体間の組み換えを高める操作を行い、もう1つのコピーも破壊された細胞を誘発した。
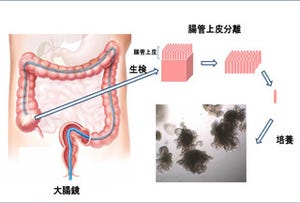
続いて、今回開発した1コピーと2コピーの遺伝子破壊を薬剤に対する耐性で区別する方法(画像2)を用いて、遺伝子が2コピーとも破壊された細胞を選択。ただし、この選択も完全ではないので、さらにこの中から破壊された遺伝子と同じ染色体に位置する一塩基多型(SNP)の多様性が消失した細胞をスクリーニングする(画像1)ことで、2コピーの遺伝子が破壊された細胞を同定した。
今回の研究の特徴は、この一連の過程を「流れ作業」にしたことにあり、各遺伝子に対する詳細な知識なしに、遺伝子破壊を行うことができる点が特徴となっている。この作業は約1カ月で完結し、複数の遺伝子に対して同時に適用可能だ。そのため、1人の研究者あたりで、年間100個程度の遺伝子について両方のコピーが破壊されたES細胞を取得できるようになる。
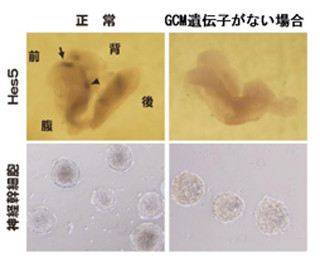
また研究グループでは、この手法を用いてさまざまな遺伝子を破壊したES細胞バンクを作成。さらに、そのES細胞バンクからは分化能力が異常な細胞株も単離されており(画像3)、ES細胞の万能性を解析する上で極めて有用であることが示されている。
なお、iPS細胞もES細胞と性質が近似していることから、今回の手法を応用することは可能だという。また、今回はマウスES細胞をモデルに用いたが、同様の原理はヒトのES/iPS細胞へも適用できるとしている。ヒトES/iPS細胞での遺伝子改変法は、マウス細胞と比べて大きく立ち遅れており、遺伝子の両コピーを破壊した例は、極少数に留まっている。今回の手法をヒトES/iPS細胞へ適用することにより、ヒトを対象とした組織・臓器形成メカニズムの研究が進展すると期待されている。