科学技術振興機構(JST)と東京医科歯科大学は10月24日、マウスでの実験において、新たな骨形成促進剤の開発につながる骨の再生に成功したことを共同で発表した。タンパク質「Semaphorin 4D」(セマフォリン4D)の働きを抑えることで、マウスの骨を再生させることに成功した。研究は、東京医科歯科大学大学院医歯学総合研究科の高柳広教授と根岸貴子客員助教らのグループによるもので、成果は英科学誌「Nature Medicine」のオンライン速報版で公開された。
骨粗しょう症は、日本においては高齢女性を中心に推計1100万人が罹患しているといわれる疾患だ。骨質の低下と低密度化によって骨が弱くなり、容易に骨折を引き起こしてしまう。脊椎や大腿骨頸部の骨折は寝たきり状態や慢性腰痛の原因となり、生活の質を低下させてしまうのはいうまでもない。また関節リウマチも、日本では推計70万人といわれる罹患率の高い関節疾患だ。こちらも重篤な場合は、骨・関節の破壊により患者の運動機能は損なわれてしまう。
高齢化が激しく進む日本においては、この骨粗しょう症と関節リウマチ、がんによる骨の破壊に対する治療法の開発は、急務の課題となっている。
これまで骨粗しょう症治療としては、細胞死を誘導する「ビスフォスフォネート剤」などで骨吸収を抑えて骨の減少を防ぐ薬剤が開発されてきたが、骨粗しょう症の病態は骨吸収が増加するだけでなく、骨形成が低下することに起因するため、骨を形成する細胞に直接的に作用して骨形成を高進させる方法が、より効果的な治療法だと考えられている。
しかし、現在、骨粗しょう症に対して使われている骨形成促進剤は副甲状腺ホルモン製剤のみと極めて限られており、病状に応じて薬剤を選択するということは不可能。また、関節リウマチやがんに見られる骨病変に対しては、骨を再生させる効果を持つ薬剤は内のが現状だ。
骨組織は古くなった骨を「破骨細胞」が吸収し、その後に吸収部位を「骨芽細胞」が新しい骨で完全に埋めることで再構築される。この家庭は「骨リモデリング」と呼ばれ、生涯にわたって繰り返され、骨組織は健全な骨量と骨質を維持していく仕組みだ。
骨リモデリングは破骨細胞や骨芽細胞といったさまざまな細胞の相互作用により厳密に制御されており、特に吸収した骨と同僚の骨を新生するために、骨吸収が引き金となって骨形成が開始される仕組みが存在している。これを「骨吸収と骨形成の共益(カップリング)機構」と呼び、その制御メカニズムの研究は世界中で活発に行われているという次第だ。
だが、骨を健常な状態で維持するためには、骨吸収と骨形成の量的バランスを保つだけでは不十分であり、新しい骨の形成は古い骨が確実に除去されるまで待機して始まらないようになっていることが必要だと考えられている。つまり、破骨細胞が骨吸収を行っている間、骨芽細胞による骨形成が何らかの仕組みで押さえられている可能性があるのだ。しかし、これまでの研究ではそのようなメカニズムが存在するか否かさえ不明で、今回、研究グループが、骨形成抑制に関わる因子とその分子メカニズムの解明を試みた、というわけである。
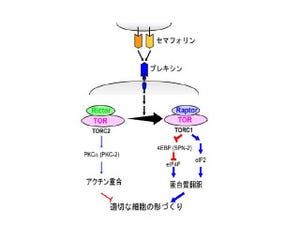
研究グループは、セマフォリン4Dが破骨細胞によって多量に生産されることを、マウスにおいて発見した。セマフォリン4Dは、これまでに神経細胞が軸索を伸ばし回路を作る過程や免疫反応に関わることで知られていたタンパク質だ。セマフォリン4Dは、骨芽細胞上に発現するタンパク質(受容体)「Plexin-B1」(プレキシン-B1)に作用し、骨芽細胞による骨形成を抑制する(画像1)。
|
|
|
画像1。破骨細胞が産生するセマフォリン4Dは、骨芽細胞上のプレキシン-B1を介して骨形成を抑制するその概略図。破骨細胞が産生するセマフォリン4Dは、破骨細胞上で受容体プレキシン-B1に認識される。そして骨吸収を行っている間に、破骨細胞はセマフォリン4Dとプレキシン-B1の相互作用を介して骨吸収部位近傍での骨形成を抑制するという流れだ |
具体的には、セマフォリン4Dにより活性化したプレキシン-B1は、骨芽細胞内で細胞内のシグナル伝達に関するタンパク質の1つ「RhoA」を活性化する。活性化したRhoAは、骨芽細胞が成熟(分化)するために必須の「インシュリン様成長因子IGF経路」を阻害することで、骨芽細胞の成熟を抑制し、骨形成を押さえることが判明した。
また骨形成を行うに当たっては、骨芽細胞が骨形成を必要としている部位へ移動してくることが重要だといわれている。今回の研究ではさらに活性化したRhoAが、「骨芽細胞の運動能」を制御して破骨細胞から離れた場所に骨芽細胞を留まらせることによって、骨形成を抑制していることも確認した(画像2)。これらの結果から、破骨細胞は骨吸収を行っている間、セマフォリン4Dを生産することによって、骨形成の開始を待機させることがわかったのである。
セマフォリン4Dやプレキシン-B1遺伝子を破壊したマウスや、RhoAの機能を抑制したマウスを調べたところ、骨芽細胞の数と骨形成率が増えて骨量も増加していることが判明。これは、セマフォリン4Dによって骨芽細胞の成熟が阻害されず、骨芽細胞が過剰に分化したためだと考えられている。正常な生体内では、セマフォリン4D~プレキシン-B1~RhoA経路が生体内の骨形成抑制に必須の役割を果たしていることが確認されたというわけだ。
さらに、卵巣を摘出する手術を行って骨粗しょう症を発症させたマウスに、セマフォリン4D経路を阻害する「抗セマフォリン4D抗体」を投与すると、骨形成が促進して骨量が回復することもわかった。従って、抗セマフォリン4D抗体は、骨を再生させる効果を持つことを証明したのである(画像3)。
今回の成果により、抗セマフォリン4D抗体および、セマフォリン4D~プレキシン-B1~RhoA経路を抑制する治療法が、骨粗しょう症といった骨減少性疾患に対して治療効果を発揮すると期待が寄せられる形となった。また、セマフォリン4Dは破骨細胞を初め、免疫系細胞や一部のがん細胞にも発現していることから、セマフォリン4Dを抑制することは、それらの細胞が関与する骨リモデリングに異常が生じる疾患である関節リウマチやがんの骨転移に見られる骨病変にも、効果があると考えられるとしている。