東京大学は10月17日、RNAとタンパク質の両方をリン酸化する酵素を発見したと発表した。同成果は、東京大学大学院工学系研究科化学生命工学専攻の鈴木勉教授および産業技術総合研究所バイオメディカル研究部門の沼田倫征研究員らの研究グループによるもので、「Nature Structural & Molecular Biology」オンライン版に10月16日付けで掲載された。
あらゆる生物はDNAに書かれた遺伝情報を基にしてタンパク質を合成する。4種類の塩基が3組で1つのコドンとなり、アミノ酸を指定するという考え方は半世紀前に確立され、セントラルドグマ(中心教義)として生命科学の根幹をなす原理の1つだ。しかし、64通りの遺伝暗号がどのような仕組みで正確に解読されるのかは、古典的なテーマでありながら、いまだに完全には解明されていないというのが現状だ。
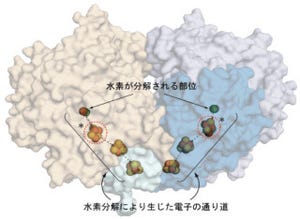
アーキア(古細菌)において、「AUAコドン」をどのようにアミノ酸「イソロイシン」へと解読するかについては、長年、この分野の研究者にとっての大きな課題となってきた。今回、研究グループは、アーキア由来の「tRNAIle」の「アンチコドン」(tRNAの34~36番目に備わった3つ組の配列で、mRNA上のコドンと対合するもの)から新規の修飾塩基である「アグマチジン」(agm2C)を発見した(画像1)。アグマチジンはtRNAに存在する修飾塩基で、遺伝暗号の解読においてAUAコドンの認識に必須である。なお、tRNAとは転移RNAのことで、遺伝暗号(コドン)を解読するアダプタ分子であり、約75塩基長のRNAだ。
マグマチジンは、「シチジン」(C)の2位に「アグマチン」(アミノ酸の一種である「アルギニン」から二酸化炭素が脱落したもの)が結合したものであり、この修飾によって「シトシン環」が「互変位性化」(水素イオンが転移することで、その化学構造が変化すること)し、「グアニン」(G)とは対合できず「アデニン」(A)と対合することで、AUAコドンを解読する機構が明らかとなっている(画像1)。
また、アグマチジンの生合成酵素については、「比較ゲノム」手法(ゲノム配列が決定された複数の生物種に、共通に存在する遺伝子を抽出することで、目的の遺伝子を探索する手法)を用いて同定され、「TiaS」(tRNAIle-agmatidine synthetase)と命名された。
TiaSはアグマチンと「ATP」を基質として、tRNAIleのアンチコドン1字目のシチジン(C34)を修飾し、アグマチジンを形成する酵素だ。今回の研究で、アグマチジンの生合成機構が詳細に調べられた結果、TiaSは3段階の酵素反応を触媒することが判明した(画像2)。
まず、ATPを「AMP」と「ピロリン酸」に加水分解する。次に、C34の2位のカルボニル基をリン酸化することにより活性化する。最後にアグマチンのアミノ基にC34の2位の炭素原子を「求核置換攻撃」させることで、リン酸基が離脱し、アグマチジンが形成されるという仕組みだ(画像2)
この触媒反応で驚くべきことは、TiaSがtRNAをリン酸化する前に、ATPをAMPとピロリン酸に加水分解する点である。このような反応を触媒する酵素(ATP加水分解酵素やキナーゼ)はこれまでに知られていない。
さらにTiaSは自身の18位にある保存された「トレオニン残基」(Thr18)をリン酸化することを見出した(画像3)。リン酸化されたThr18は、agm2C形成反応に重要な役割を担っていると考えられている。
また、共同研究先である産総研の沼田研究員のグループは、TiaS-tRNAIle複合体の結晶構造を解明(画像3・A)。TiaSはRNA(C34)とタンパク質(Thr18)の異なる基質をリン酸化する、これまで知られていなかった新規ドメインを有することが明らかとなった。なお、このドメインは「TCK」(Thr18-C34 kinase)ドメインと命名されている。
リン酸化Thr18は、TCKドメインのATP結合部位に存在し、特にβとγリン酸基の近傍がその位置するところだ。従って、リン酸化Thr18とγリン酸基の間には負電荷同士の反発が生じ、ピロリン酸からC34へのリン酸化を促進している可能性がある(画像3・B)。
さらに、リン酸化後にリン酸化Thr18とリン酸化C34の間で負電荷同士の反発が生じ、リン酸化C34をアグマチン結合ポケットまで移動させる役割(画像3・C)があるのではないかと推察された。
これまでに、RNAのみもしくはタンパク質のみをリン酸化する酵素は多数知られてきたが、今回の研究によって、RNAとタンパク質というまったく異なる生体高分子をリン酸化する酵素が世界で初めて見つかったことになる。この性化は、RNA、タンパク質、酵素など生命科学全般において、大きな衝撃を与えるものとなった。また、遺伝暗号の成立基板を分子レベルで明らかにした成果でもあった。