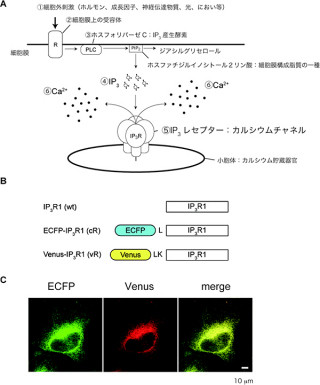
北海道大学(北大)は9月9日、カナダ・アルバータ大学、九州大学と共同で、細胞活動の指標となるカルシウムイオン(Ca2+)を鋭敏に検出可能な青、緑、赤の各色蛍光性Ca2+センサタンパク質の開発に成功したと発表した。北海道大学電子科学研究の永井健治教授の研究グループ、アルバータ大学化学科ロバート・キャンベル教授、九州大学理学研究院生物科学部門の石原健教授らによる研究で、研究成果は、9月9日(日本時間)に「Science」電子版に掲載された。
下村脩博士らのノーベル賞受賞で知られる緑色蛍光タンパク質「GFP」に代表される蛍光タンパク質は、細胞や生体分子を蛍光標識することを主用途として、現在では医学・生物学研究に広く用いられている。
近年では、GFPを遺伝子光学的に改変することにより、細胞内の酸素の活性化やイオンの濃度変化などを計測することができる系高分子センサも開発されている状況だ。細胞内の信号伝達を担うCa2+を生きた細胞内でリアルタイムに検出するセンサとしては、「cameleon」(カメレオン)や「pericam」(ペリカム)、「GCaMP」(ジーカンプ)などがあり、世界中で利用されているが、これらのCa2+センサは計測波長域が青緑色から緑色域に限定されていたり、Ca2+結合に伴う蛍光シグナル変化が小さいためにわずかなCa2+濃度変動をとらえることができないという短所があったのである。
Ca2+が関わるさまざまな生理現象をより詳細に理解するには、その生理現象に関与するほかの生体因子との関連を同時に調べることがポイントだ。あるいは細胞内のコンパートメントごとにCa2+がどのように変化するのか、その時にそのほかの生体因子がどのような振る舞いを見せるのかなどを解析する必要がある。
そうした研究を可能にするためには、蛍光Ca2+センサと蛍光ラベルされた生体分子を同じ細胞に導入して観察する必要があり、その際には両者を区別するため、蛍光ラベルされた生体分子の蛍光色とは異なる蛍光を発するCa2+センサが不可欠だ。しかし、これまでのCa2+センサは前述したように、青緑色から緑色域に限定されていたため、異なる蛍光色で計測できるCa2+センサの開発が待ち望まれていたのである。
そこで今回の研究では、GFPの円順列変異体を利用した緑色蛍光Ca2+センサである「GCaMP3」の遺伝子に「エラー誘発PCR法」を用いてランダムに遺伝子変異を導入。それを大腸菌の細胞膜の外側部分の「ペリプラズム」に発現させた。この大腸菌をCa2+が存在する溶液、または存在しない溶液にさらして蛍光シグナルを計測し、Ca2+の有無によって蛍光シグナルが最も大きく変化する大腸菌を選択して培養してそこからより高性能のCa2+センサの遺伝子を単離。それを何度か繰り返すことで、研究グループはまず2600%ものシグナル変化率を有する緑色センサ「G-GECO」(ジーゲッコー:green fluorescent genetically-encoded Ca2+ indicators for optical imaging)の開発に成功したのである(画像1・A)。
このG-GECOの蛍光団を構成するアミノ酸の一種である「チロシン」を「ヒスチジン」に置換することで、青色センサ「B-GECO」を開発(画像1・B、C)。また、赤色蛍光タンパク質「mApple」をもとにした赤色センサ「R-GECO」の開発にも成功した(画像1・B、C)。
さらに「エラー誘発PCR法」において、B-GECO、G-GECO、flash-pericamの遺伝子混合物を鋳型に利用することで、Ca2+の結合により蛍光色が緑から青色に変化する「GEM-GECCO」を開発することに成功した(画像1)。GEM-GECOはCa2+の結合により、蛍光シグナル(青の蛍光強度/緑の蛍光強度)が1万1000%も変化する点が特筆すべき点となった。この変化率はこれまでのものよりズバ抜けて高く、世界最高の値を示している(画像1・D)。そのほか、励起2波長計測型「GEX-GECO」も開発された。
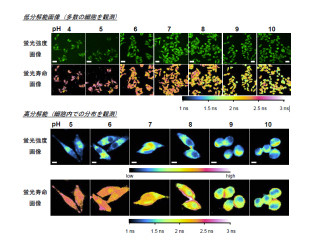
これらGECOシリーズの性能は細胞内で維持され、極めて高いコントラストで細胞内のCa2+変動を観察することができるようになっただけでなく、細胞質、核、ミトコンドリアという3種類のコンパートメントにおけるCa2+の動態を同一細胞内で測定すること(画像2)や、Ca2+とATPの同時計測にも成功している(画像3)。
また、ラットの海馬神経細胞(画像4)や、線虫「C.elegans」の臭覚需要応答に関わる神経細胞の活動(画像5)をGEM-GECOを用いて測定したところ、従来のセンサよりも鋭敏に神経活動をとらえることができた。
今後の展開としては、励起・蛍光波長が多様なGECOシリーズは、光照射により細胞の活動やタンパク質の機能を制御することができる光遺伝学的技術と組み合わせることで、例えば神経回路の人為的な活動制御と測定を同時に行えるようにもなる。それにより、行動、思考、記憶などの過程における神経回路の動作メカニズムの解明がより一層進むものと期待されているとした。