BNCT(ホウ素中性子捕捉療法:Boron Neutron Capture Therapy)は、がん細胞を選択的に死滅させることができるため副作用が少なく、さらに30分から60分程度の治療を1、2回行うだけで済むなどといったメリットがあり、画期的な次世代治療法として世界的に注目されている。
直接加速器を用いた病院設置型BNCTシステムの導入を進める国立がん研究センター(国立がん研)は、2014年の中央病院診療棟の完成とともに、加速器室およびBNCT室を設置し、2015年11月に原子力安全技術センターの施設検査に合格している。今後、物理試験や生物試験を経て、2016年度末の治験開始を目指していくという。本稿では、この国立がん研のBNCTシステムを例に、BNCTの仕組みやそのメリット、今後の課題について解説していく。
超選択的な放射線治療法「BNCT」のしくみ
BNCTの原理は、質量数10のホウ素10Bと熱中性子の核反応によって放出されるα粒子(質量数4のヘリウム4He原子核)と質量数7のリチウム7Li原子核によってがん細胞を破壊するというもの。核反応後に放出されるこれら2つの粒子の飛距離は、α粒子が9μm、7Li原子核が4μmといずれも短く、到達範囲が細胞の大きさを超えないため、その効果はホウ素を集積したがん細胞に限定される。したがって、がん細胞に選択的、かつ十分量が集積するホウ素化合物があれば、これを患者へ投与した後に中性子を照射することで、がん細胞だけを破壊することが可能になるというわけだ。重粒子線治療を含む従来の放射線治療に比べ、BNCTは超選択的な放射線治療法であるといえる。
|
|
BNCTのしくみ。中性子とホウ素の核反応により発生するα粒子と7Li原子核によってがん細胞を破壊する。これらの放射線の到達範囲は細胞の大きさを超えないため、BNCTの効果はホウ素を集積したがん細胞に限定される |
ホウ素化合物として現在臨床で用いることが可能なのは10B-BPAだが、質量数18のフッ素18Fで標識された10B-BPAの類似物質となる18FBPAという薬剤を用い、PET(陽電子放出断層撮影法:Positron Emission Tomography)検査をあらかじめ行うことで、腫瘍に蓄積するホウ素量を定量的に知ることができ、BNCTによる効果をある程度予測することができるという。国立がん研究センター 伊丹氏は、「18FBPAが集積しない症例に対して、むやみにBNCTを行うことにあまり意味はない。事前予測を含め、BNCTはシステムとして捉えていく必要がある」と説明している。
|
|
国立がん研は、CICSと日立製作所の子会社であるAccSys Technologyとともに、BNCTシステムを中央病院に導入するため準備を進めている。写真左から、AccSys Technology 会長 浅野克彦氏、CICS代表取締役副社長 伏見有貴氏、同代表取締役社長 今堀良夫氏、国立がん研究センター 理事長 堀田知光氏、同中央病院長 荒井保明氏、同中央病院 放射線治療科長 伊丹純氏 |
国立がん研の最新BNCT装置とは
日本でBNCTが行われるようになったのは1968年。当時、熱中性子・熱外中性子の供給源としては原子炉が唯一のものだった。しかし、原子炉はもともと医療施設ではなく、患者が利用するには不便な場所にあるうえ、核燃料の安全性といったところにも課題を抱えており、原子炉を用いたBNCTは医療として普及の限界があると考えられていた。
一方、加速器を中性子源とするBNCTは、核燃料を使用しないため安全性が高く、電源を切れば放射線は射出されない。また小型化が可能ということもあり、病院設置型の加速器を導入すれば、「医療として普及する可能性がある。これから検証していく必要はあるが、少なくともこれまでその俎上にすら載らなかったものが、これでようやく載ったといえる」と伊丹氏はその可能性について語る。
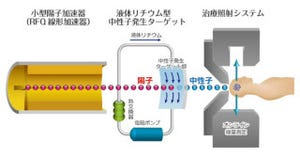
加速器にもその形状やターゲットによってさまざまなタイプがあるが、BNCT加速器の大まかな仕組みはこうだ。加速器から引き出された陽子ビームを、リチウムLiやベリリウムBeなどのターゲットに照射して中性子を発生させる。この高いエネルギーを持つ中性子を、治療に最適なエネルギーとなる熱・熱外領域まで減速させ、がん細胞に照射する。
たとえば、福島県・南東北病院のBNCT加速器はサイクロトロン型で、陽子を30MeVまで加速させるもので、ターゲットにはBeを利用している。一方、国立がん研では、直線型の加速器を採用。これは2.5MeVまで加速させた陽子を、Liターゲットに衝突させるというタイプのものだ。同じ直線型の加速器としては筑波大学グループのものがあるが、こちらは陽子を8MeVまで加速させており、ターゲットにはBeを採用している。
Liターゲットのデメリットとしては、約180℃というLiが持つ低い融点のため、強力な冷却システムが必要となる点があげられる。このため国立がん研のBNCT加速器では、1分間に約150リットルの流水を用いて冷却する水冷システムを採用している。また、Liターゲットが放射化し、放射性同位元素である質量数7のベリリウム7Beが生成するといった課題もある。これについては、自動洗浄システムおよびリボルバー形式のターゲット再生システムによって解決されている。
「Liターゲットが困難であるということは最初から認識していた」という伊丹氏。それでもLiをターゲットとして採用したのには理由がある。それは、低エネルギーな陽子を利用しているということだ。この場合、発生する中性子の減速が容易で、人体に悪影響を及ぼす可能性の高い高速中性子の混在が少ないというメリットがある。
また、小さいシステムなので上から吊るすことができ、上から下に向かって中性子を照射できるというのも国立がん研のBNCTシステムの特徴だ。同中央病院診療棟の地下1階にある直線加速器は長さ4m程度のコンパクトな大きさとなっており、陽子を90度曲げて地下2階のBNCT照射室でターゲットと反応させる形となっている。
|
|
|
国立がん研のBNCTシステムのイメージ。地下1階にある直線加速器を90度曲げて、地下2階照射室でターゲットと反応させ、治療を行う |
加速器室。加速器は当初予定していたものよりコンパクトだったため、電源系統と冷却系統も一緒に入れている。加速器自体は長さ4mとコンパクト |
|
|
|
|
BNCT照射室。直径25cmの照射口に患部を押し付ける |
|
世界をリードする日本のBNCT用治療装置開発
国立がん研は、2016年度末の治験開始を目指しているというが、その対象は現在協議中だ。PETでホウ素の集積を確認することができて、なおかつ体表面から6.5cm以内となる腫瘍が望ましく、悪性黒色腫などが対象となる可能性が高いというが、一番のポイントとなるのはより適切にホウ素が集積するかどうかだ。伊丹氏は、「加速器ももちろん重要だが、ホウ素集積の正確な事前判断や、DDSなどを用いた腫瘍にだけ集積するより良いホウ素化合物の追求なども含め、システム全体として取り組んでいかなければならない」としている。
国立がん研のBNCTシステムについては、欧州諸国からの視察もあるという。日本はBNCT用治療装置の開発において長年にわたって世界をリードしてきており、現在は、国立がん研だけでなく、京都大学、南東北病院、筑波大学など、日本各地でそれぞれが切磋琢磨しながら開発を進めているという状況だ。今後の日本発の最新がん治療技術の発展を期待したい。