新エネルギー・産業技術総合開発機構(NEDO)とLSIメディエンス(旧・三菱化学メディエンス)は7月2日、不整脈を誘発する危険性があるかないかという心臓への影響を調べるための「ヒトiPS細胞を活用した医薬品副作用高精度予測システム(評価システム)」を開発したことを発表した。その会見の模様をお届けする。
ヒト細胞を使用した医薬品開発は、動物実験の弱点を克服し、創薬の成功率を向上させることが期待されており、世界中で競うようにして開発が進められているところだ。また、ヒト細胞を使用した医薬品開発は動物実験代替法として、動物愛護管理法に定められた原則である、「苦痛の軽減(Refinement)」、「代替法の活用(Replacement)」、「使用数の削減(Reduction)」のいわゆる「3R」にも貢献するという点でも期待されている。それににも関わらず、生命倫理や医学的な観点からヒト細胞の創薬への活用は大きな制約を受けてしまっているのもまた現状だ。
医薬品の安全性評価において、心臓や神経系、呼吸系に対する副作用は生死に関わる可能性が高いため、開発中の医薬品(化合物)における副作用の有無は特に詳細に調べる必要がある。今回開発されたシステムは心臓に関するものだが、同臓器に関しては、化合物に致死性不整脈の潜在性がないことを評価することが義務づけられているという具合だ。病気を治すはずの医薬品で、心臓が止まってしまったのでは話にならないのはいうまでもない。
現行のICH(日米EU医薬品規制調和国際会議)ガイドラインの「ICH S7A(完全性薬理試験ガイドライン)」および「ICH S7B(ヒト用医薬品の心室再分極遅延(QT間隔延長)の潜在的可能性に関する非臨床評価ガイドライン)」では、前臨床と臨床試験(治験)の心毒性(不整脈などを誘発しないかどうかの心臓に対する毒性のこと)評価について、前臨床と臨床試験のそれぞれに試験が採用されいているが、それぞれの試験が課題を抱えているのが現状である。
前臨床試験では、動物試験あるいは動物心筋組織を用いた心毒性試験と、ヒト心筋と類似した性質を付加した動物細胞を用いた心毒性試験が採用されているが、課題はヒトへの外挿性、つまり人間への応用に関するデータとして難がある点だ。また臨床試験においては健常者を対象とした心毒性試験が行われているが、課題としてはコストが高く、倫理性にも問題があるという点が上げられている(画像1)。
筆者も、健康診断を兼ねて(細かく血液検査をしてくれるので)、年に数回糖尿病治療薬の治験の初期診断には参加するので、治験の協力費のことはある程度知っているが、糖尿病の場合は本採用となると、協力費として低額なものでも1回の通院で1万円、高額なものになると1週間の入院で10万円単位、さらに数週間から1カ月のものになると数10万円が支払われる(とても儲かりそうだが、糖尿病の場合は「安定して」悪い状態が続かないとダメなので、そう簡単には本採用にならない)。よって、心臓病の臨床試験というのは、おそらく危険性が糖尿病に比べると遙かに高いと思われるので、協力費はさらに高額になるのではないかと予想される。
また、前臨床試験の動物試験で安全性に問題が出た時点で、開発を断念することになっている点も創薬におけるコスト(時間、労力を含める)の面から大きな課題となっている。動物実験で安全性に問題が出た化合物が、そのままヒトにも当てはまる場合ももちろんあるので、動物試験で問題が出たらその化合物は使えないとなるのは安全性の面から当然といえば当然なのだが、実はヒトの場合には安全性に問題がない場合もあるという(画像2)。
マウスやラットを筆頭に、イヌやサルなども動物実験のモデル動物として用いられるわけだが、同じほ乳類だからといって、ヒトと似ているところばかりかというと、そうではないのだ。まず体格が大きく異なっているので、その点による影響も大きい。イヌやネコを飼っている方なら特にご存じかと思うが、ヒトと同じ味付けでご飯を上げてしまうと、塩分が濃すぎて腎臓を壊してしまうことはよく知られている。
また、免疫系や代謝系、神経系なども基本はヒトと同じだが、100%すべてというわけではないため、マウスだとダメだけど、ヒトではまったく問題ない、といったケースもあるのだ。しかし、現状では動物実験の段階で何らかの問題が生じたら、「問題のある化合物」として、開発が断念されてしまっているのである。
動物実験の段階というと、それなりに開発を進めてきているわけで、それがすべてご破算ということになると、それまでにかけられた費用や時間もすべてほぼ無駄になってしまう(この化合物はダメ、というデータは残せるが)。創薬する企業にとってその段階での開発中止のダメージを無視できるかというと決してそうではなく、もっと早い段階でダメなものを外せる選別を行えた方が望ましいことこの上ない。
同時に、現状で人体に有害な影響を及ぼさず、なおかつ効果のある化合物を作り出すのは、3万分の1とされ、非常に確率が悪いことも大きな課題となっている。こうした創薬における確率の低さ、コストの問題、それにつながる「誤った判断」をなくすため、ヒトでの安全性のみをできるだけ正確に予測する評価方法が求められているというわけだ。
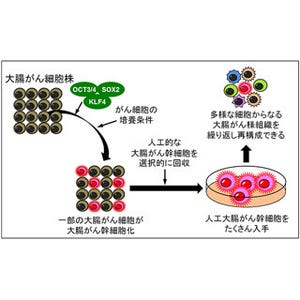
これらの課題や最初に述べた制約の問題などを解決する技術として現在期待され、すでに応用が始まっているのが、iPS細胞の創薬への利用だ。iPS細胞技術は、一般的なイメージとしては機能を失った組織に移植したり、臓器そのものを作り出したりする「再生医療」のための技術というもので、実際にそれを実現するためのホープとして世界中でそれこそ研究されているわけだが、実は創薬のための新たな化合物の毒性を「味見させる」という、産業応用での使い方にも応用できるのである(画像3)。今回のシステムは、そのiPS細胞を使った毒味役のシステムであり、これまでに挙げたさまざまな課題を解決できるシステムでもあるというわけだ。
iPS細胞を使うメリットは、まず生命倫理の問題を考慮する必要がなくなる。ご存じの方も多いかと思うが、ヒトの皮膚の線維芽細胞などから作るので、生命そのものではないし、ES細胞のように生命である胚を壊して作るわけでもない。そしていうまでもないが、動物モデルの必要がなくなる。ヒト自身の細胞だから、わざわざモデル動物を使う必要がないからだ。
そうした理由から、実際、世界中の製薬企業が、バイオベンチャー企業から市販されているiPS細胞由来の分化細胞を購入して活発な研究を行っているという。そうした中で、医薬品候補化合物の心臓毒性評価に向けた評価系の構築が進んでいるのが、ヒトiPS細胞由来心筋細胞「iPS-CM」の応用というわけである。
日本においては、NEDOが2008年度から2013年度の6年間に約30億円をかけ(2008年度は補正予算で実施された)、ヒト幹細胞を用いた創薬スクリーニングシステムの開発(評価対象は心毒性評価)を目標として、「ヒト幹細胞産業応用促進基盤技術開発プロジェクト」を実施した(画像4・5)。
同プロジェクトでは、2つの課題があり、3者が分担。課題1の「iPS細胞など幹細胞から心筋細胞への高効率な分化誘導技術の開発」は慶應義塾大学医学部が担当した。課題2の「iPS細胞など幹細胞を用いた創薬スクリーニングシステムの開発・評価」は、東京医科歯科大学(TMDU)生体材料工学研究所と、LSIメディエンスの担当である。またTMDUとLSIメディエンスの役割分担は、前者が心筋細胞を用いた評価技術の開発、後者が実用化に向けた既存薬剤を用いた評価システムの評価という具合だ。これは、ヒトへの外挿性が高い心毒性評価試験を事業化するのが狙いである。
そして開発されたのが、ヒト心電図に似た波形であるiPS-CMの細胞外活動電位を経時的に記録し、化合物の影響を評価するというシステムだ(画像6)。特徴の1つ目は、スループット向上のための仕組みとして、最大で8連ウェルで培養したiPS-CMを用いて、多検体同時測定を可能にしたこと(画像7)。2つ目は、新開発された測定用の恒温CO2インキュベータ(環境が一定に保たれた密閉容器)に測定装置の計測部分を格納したことで、安定的なデータの取得を実現したことだ(画像8)。
|
|
|
|
|
画像6(左):今回のヒトiPS心筋細胞を用いた心毒性評価システムの開発の特徴。画像7(中):最大8連のマルチウェル測定プレートで、同時に8検体が。画像8(右):左が多検体測定用の専用インキュベータ。右下の一群の装置は、細胞外電位測定装置 |
||
3つ目は、64点という多点電極上のiPS-CM(画像9)から同時取得した波形を短時間で解析し、不整脈誘発性の評価に重要なパラメータを自動算出するソフトウェアを新規に開発したこと(画像10・11)。8連ウェルそれぞれのiPS-CMの64点からデータが取得されるわけで(画像12)、これもいわゆるビッグデータであることから、その解析を自動化できなければ厳しいわけで、それもきちんと対応しているのである。さらに、それらに加えてiPS-CMの細胞外電位を「強制刺激下」で取得する機能も備えられており、化合物ごとの特性に合った最適な測定が可能になったという。
ちなみに多点電極とは、培養ウェルの底面に電極を配置し、電極周辺に発生している電位をとらえる仕組みを持ったシステムである。また強制刺激とは、外からの電気刺激を細胞に与え、細胞の発火・興奮を誘発する方法のこと。心筋細胞においては規律的な拍動などを体外で再現できる手法である。なお、計測プレート上のヒトiPS心筋の様子が動画1。画面中の黒い四角が多点電極だ。実験では、電気刺激によって、自律拍動のタイミングが1.3秒だったところを1秒(1Hz)に拍動同調させ、それが1時間以上という超時間持続させることにも成功している(画像13)。
それから、特徴の1つである、新規開発のソフトウェアだが、8ウェルの細胞それぞれにおける64点の電極から同時計測が可能なことは述べたが、その細胞外電位の値をすべて並列表示させることも可能だ。その取得された波形(つまり、心臓の拍動に等しい)において、ナトリウムチャネルが主成分の1stピークと、カリウムチャネルが主成分の2ndピークの間を「細胞外電持続時間(FPD)」として算出し、その上で隣り合った波形のFPDのばらつきを「STV(Short Term Variability)」として算出。
このFPDとSTVの組み合わせは、催不整脈作用を正確に予測する有効な指標となることが確認されており、不整脈を起こしやすくなる場合はFPDが長くなるか、STVのばらつきが大きくなるケースだという。そのほか不整脈に関連して、「早期後脱分極(EAD)」という指標も同ソフトウェアは監視することが可能で、化合物が不整脈を誘発する可能性を確認しやすくなっているというわけだ(画像14)。スクリーニングできる量は、1日18化合物は確認できているようで、まだそれが限界ではないそうで、スピードアップは可能だという。
こうして完成した評価システムを用いて、ヒトで致死的不整脈の誘発リスクが医薬品添付文書に記載されている化合物を含めた検討(自律拍動下では31化合物、および強制刺激下では11化合物)を行ってみたところ、高い予測率を示すことに成功したという。それにより、創薬スクリーニングへの有用性が実証された、ビジネスとしてもスタートさせたというわけだ(おおよそ100万円からという説明)。
自律拍動下での31の化合物に関してまとめた、「ヒトで致死的不整脈リスクが示されている化合物の評価結果」が、画像15である。この中の項目の「陽性検出率」とは、不整脈リスクが医薬品添付文書に記載されている化合物を陽性判定とした割合で、そのパーセンテージの下にあるカッコ内の数字は、それぞれの化合物数を示したもの。今回の方式は、既存の「hERG法」や「ex-vivo APD法」と比較して、全項目で上回っている。
また「陰性検出率」に関しては、まず陰性についてだが、不整脈リスクが医薬品添付文書に記載されていない化合物の内、各法で催不整脈作用を示唆する知見が得られなかった化合物のことをいい、陰性検出率はその割合を表したもの。同じくパーセンテージの下にあるカッコ内の数字は、その化合物の数だ。そして「一致率」は、今回検討された化合物の内、添付文書の記載と実験結果が一致した化合物の割合を示し、カッコな委はそれぞれの化合物数が記されている。さらに、既存法(1)の「hERG法」の陽性検出率「59%」と低かったことについては、hERG法が対象とするカリウムイオンチャネル作用以外の心毒性を有する化合物が多く含まれるためだという。
そして、各薬剤の詳細な内容を表したのが画像16だ。左の列の催不整脈作用誘発化合物は、下の2つをのぞいて、赤枠の中においてバーの色が不整脈リスクがあることを示す赤か、拍動停止の黒である。厳密には、下の2つも赤が一部出ており、危険性があることは間違いないという。なお赤枠は、1倍から1000倍までの血中濃度を表し、それ以下、それ以上は通常は投与されない(通常は1倍だが、リスク評価のために1000倍までが重要視される)。右の催不整脈作用陰性化合物に関しては、赤枠の中で拍動停止の黒が出ている化合物が1つあるが、ほかは問題ない形となっている。なお、既知の薬剤評価では、強制刺激条件下で補正式を使わずに評価できるという。
画像17は、ヒト幹細胞由来心筋と、動物(イヌ)モデル実験結果との相関を表したもの。これにより、In vivo環境(試験管内の制御された環境を意味する「In vitro」の反対で、生体内における、制御されてない環境の意味)と相関する催不整脈作用予測系を構築できる可能性が示されたとしている。画像18は、強制刺激条件下での既知薬剤評価一覧で、今回のシステムでは補正式を使わずに評価できることを示したものだ。
また今回の評価システムに関しては、平成27年のICHに日本から提案する予定としており、その点に関してNEDO バイオテクノロジー・医療技術部の山崎知巳部長は、日本が世界に先駆けて今回の技術を発信し、世界をリードしていくことにも意義があるとしている(画像19)。また、今回はLSIメディエンスから、創薬支援事業本部の井上裕章副本部長、同本部先端事業推進室の長田智治氏、同・関島勝氏らが出席して解説を行った。
それから医薬品の心臓毒性評価におけるヒトips-CMの仕様は、近い将来に「安全性試験」(医薬品候補化合物を含めた新規化合物の安全評価試験)のガイドラインに採用されることが期待されているという。そして今回の多点電極評価システムは、心筋細胞以外の細胞にも適用することが可能なため、そうした開発が今後は期待されるともしている。