理化学研究所(理研)は2月17日、マイルドな環境ストレスにより誘導される個体のストレス耐性「ホルミシス効果」が、小分子RNA(small RNA)による組織間コミュニケーションを介して子孫へ継承されることを発見したと発表した。
同成果は、理研 生命機能科学研究センター 老化分子生物学研究チームの岡部恵美子リサーチアソシエイト、同・宇野雅晴研究員、同・西田栄介チームリーダーらの研究チームによるもの。詳細は、科学雑誌「Communications Biology」に掲載された。
生物は常に、ウイルス感染や飢餓、温度変化などさまざまな環境ストレスにさらされている。過度なストレスは生物に悪影響を与えるが、マイルドなストレスはストレス耐性を誘導し、結果的に個体に有益となることが知られている。微量なストレスや有害物質が個体にとって有利な効果を示すことを、ホルミシス効果という。
これまで研究チームは、モデル生物である線虫を用いた実験から、親にマイルドな環境ストレスを与えることで獲得される酸化ストレス耐性の上昇が、数世代にわたり子孫へ継承されることを明らかにしてきた。さらに、酸化ストレス耐性の継承には「エピジェネティクス」(DNA塩基配列の変化に依存しない遺伝子調節機構のこと)による制御を介した体細胞-生殖細胞の組織間伝達が必要であることも解明している。
しかし、親が獲得したストレス耐性を子へ継承させる分子や経路の詳細については、まだ詳細がわかっていない。そこで研究チームは今回、マイルドな環境ストレス(高浸透圧刺激)により誘導される酸化ストレス耐性が、子孫へ受け継がれる分子メカニズムの解明を試みたのである。
線虫では、主要なエピジェネティクス制御因子のひとつとして、タンパク質への翻訳に関わらない「ノンコーディングRNA」が知られている(タンパク質をコードするのは「メッセンジャーRNA」)。今回の研究においては、ノンコーディングRNAの一種である小分子RNA(small RNA)が注目された。small RNAは長さが20~30塩基対という短さで、細胞分化や発生など、さまざまな生命現象に関与することがわかっている。今回は、酸化ストレス耐性の継承に関わる、small RNAによる経路の同定が試みられた。
small RNAには3種類のクラスがあり、ひとつは生殖細胞のみで発現し、「endo-siRNA」と「microRNA」のふたつのクラスは体細胞でも発現する。ストレス耐性の獲得と継承には、体細胞から生殖細胞へのストレス情報の伝達が重要だと考えられるため、体細胞で発現するendo-siRNAとmicroRNAの役割についてまず検討が行われた。
親世代で浸透圧刺激を与えて育てた正常個体(野生型)の線虫では、親世代と子世代の両方でストレス耐性の上昇が確認された。一方、endo-siRNA経路が機能しない変異体においては、親世代ではストレス耐性の上昇が見られたが、子世代では見られなかったという。
また、microRNA経路が機能しない変異体では、親世代と子世代の両方でストレス耐性の上昇が確認されなかったとした。このことから、endo-siRNA経路はストレス耐性の継承に関与し、microRNA経路はストレス耐性の獲得および継承に関与することが判明したのである。
-
ストレス耐性の獲得とその継承に関わるsmall RNA。(左)正常な個体にマイルドな環境ストレス(浸透圧刺激)を与えると、酸化ストレス耐性が上昇し、その効果は子世代にも伝わる。(中)endo-siRNA経路が機能しない変異体では、親世代ではストレス耐性が上昇したが、その効果は子世代に継承されないことが確認された。(右)miRNA経路が機能しない変異体では、親世代と子世代の両方でストレス耐性が上昇しないことが確認された (出所:理研Webサイト)
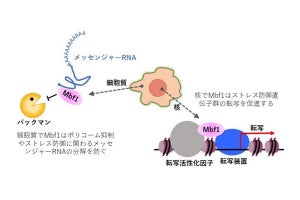
small RNAはほかのRNAと同様に核内で生成されるが、一部のsmall RNAは細胞外に分泌されることが知られている。small RNAがストレス耐性情報を親から子へと伝えるシグナル分子であれば、ある組織で放出されたsmall RNAが別の組織に作用している可能性が考えられるという。
そこで、small RNAを細胞内へ取り込む膜チャネルをコードする遺伝子の変異体を用いて、ストレス耐性の解析が実施された。その結果、endo-siRNAやmicroRNAの発現は正常であるにも関わらず、膜チャネル変異体では親世代、子世代共にストレス耐性の上昇が見られなかったとした。このことから、small RNAの組織間輸送は、ストレス耐性の獲得と継承の両方に必要であることが確認されたのである。
さらに、膜チャネルをコードする遺伝子を組織ごとにノックダウンする実験から、ストレス耐性の獲得には腸組織への、ストレス耐性の継承には生殖腺へのsmall RNAの取り込みが必要であることが判明したとした。
ストレス耐性の継承には、endo-siRNAの機能と生殖腺へのsmall RNAの取り込みが必要であることが明らかになったことから、続いては生殖腺特異的に機能するendo-siRNA経路(germline nuclear RNAi経路)が、ストレス耐性の継承に関与するかどうかの解析が行われた。すると、germline nuclear RNAi経路の因子とその下流で働くヒストン(DNAが巻き付く芯のようタンパク質)修飾因子が、ストレス耐性の継承に関わることが確認されたのである。
最後に、シグナル因子として働くsmall RNAがどの組織で生成されることが、ストレス耐性の獲得と継承において重要であるかの調査が行われた。その結果、ストレス耐性の獲得には神経で、ストレス耐性の継承には腸組織でmicroRNAが生成されることが必要であることが明らかとなったのである。
-
small RNAを介した子孫へのストレス耐性の継承メカニズム。ストレス耐性の「獲得」には、small RNAが神経で生成され、腸に取り込まれることが必要だ。一方、ストレス耐性の「継承」には、small RNAが腸で生成され、生殖腺に取り込まれることが必要。この結果、生殖腺ではヒストン修飾によるエピジェネティックス変化が生じる (出所:理研Webサイト)
これらの結果より、高浸透圧により神経、腸で生成されたmiRNAが、生殖腺で機能するendo-siRNAとヒストン修飾因子を介してエピジェネティクス変化を引き起こすことで、親から子孫へとストレス耐性が受け継がれることが解明された。
今回の研究により、マイルドな環境ストレスにより誘導されるストレス耐性が、複数のsmall RNA経路を介した組織間コミュニケーションにより子孫へ受け継がれることが初めて明らかとなった。この現象は、親が経験した環境情報をsmall RNAへと変換し子孫の適応力を高めるという、ホルミシス効果の継承による生物の生存戦略のひとつである可能性が考えられるという。
近年、さまざまな生物種において、親が獲得した形質が遺伝する現象が報告されている。small RNA経路は線虫からマウス、ヒトに至るまで広く保存されていることから、ほかの生物種に対しても、この現象を理解する上で重要な知見となると期待できるとしている。